
|
|
|||||
|
||||||
國家藥品抽檢年報(2023)摘要:
2023年是全面貫徹黨的二十 大精神的開局之年,也是實施“十四五”規劃承上啟下的關鍵之年,國家藥監局認真貫徹習近 平總書記關于藥品監管工作的重要指示批示精神,堅決貫徹黨中央、國務院決策部署,服務國家重大醫藥政策執行,緊緊圍繞藥品監管實際需求及藥品生產經營結構的動態變化,聚焦監管重大戰略、重點品種、重點環節,精心組織實施藥品抽檢工作,持續筑牢藥品安全底線,提升藥品監管效能,組織各省(自治區、直轄市)藥品監管部門與相關檢驗機構,在全國范圍內對部分生產、經營、使用等環節的藥品質量開展抽查檢驗工作,評估上市后藥品的質量狀況,打擊制售假劣藥品行為。通過持續完善藥品抽檢管理體系,不斷創新監管的制度機制和方式方法, 協同高效做好新形勢下的藥品抽檢工作。2023年國家藥品抽檢結果顯示,當前我國藥品安全形勢總體平穩可控,藥品質量持續保持在較高水平。
一、概述
藥品抽檢作為藥品上市后監管的重要手段之一,是實現風險管理、科學管理、監管前置的重要技術支撐。多年來,在打擊違法違規、震懾不法企業、評價藥品質量狀況、提升行業標準、警示公眾用藥風險、助力科學監管等方面發揮著重要作用。2023年,為貫徹落實《中人民共和國藥品管理法》和《中華人民共和國疫苗管理法》,國家藥監局根據《藥品質量抽查檢驗管理辦法》等有關要求,“四個最嚴”為根本遵循,緊緊圍繞藥品監管實際需求,聚焦重點任務,完善運行機制,創新監管方式,采取“分散抽樣、集中檢驗、探索研究、綜合評價”的抽檢模式。統籌組織全國31個省(自治區、直轄市)和新疆生產建設兵團遵循分級抽樣模式抽取樣品;由中國食品藥品檢定研究院等47個承檢機構負責檢驗樣品,構建以問題為導向的藥品質量研究評價體系,揭示可能存在的質量安全隱患,同時繼續完善風險分級監管機制,對發現的問題隨時報告、隨時研判、隨時處置。另外,通過優化藥品抽檢模式,探索精準監管、信用監管、智慧監管;部署各省局結合投訴舉報、網絡監測等探索開展網絡抽檢,探尋線下線上不同來源藥品是否存在質量差異;持續增強中藥材質量監測力度等監管策略,進一步提升抽檢服務監管的效能。
2023年國家藥品抽檢共完成132個品種18762批次制劑產品與中藥飲片的抽檢任務,樣品來源涉及1114家藥品生產、2528家經營企業和511家使用單位。對檢出的136批次不符合規定產品,國家藥監局組織各省(自治區、直轄市)和新疆生產建設兵團藥品監管部門,及時采取相應的風險控制措施,通過科學分析研判,確定風險點,對涉事企業和單位依法進行查處,對個別企業存在違法違規生產、質量管理水平較低、藥品質量保障體系存在缺陷等問題,依風險等級不同分別開展了有因檢查、風險提示、督促整改等相應的監管措施。通過對不合格產品查控和信息公開、對風險線索核查處置,對藥品從業主體形成了強烈震懾,使其強化了藥品全生命周期和全過程質量控制的意識。
二、抽檢數據分析
(一)抽樣情況
2023年國家藥品抽檢共抽取制劑產品與中藥飲片品種132個,包括化學藥品74個、中成藥43個、中藥飲片9個、生物制品6個,其中國家基本藥物品種48個;共抽檢樣品18762批次,包括生產環節4272批次、經營環節13248批次(其中,互聯網環節207批次)、使用環節1242批次(見圖1),涉及1114家藥品生產企業、2528家藥品經營企業和511家藥品使用單位。其中,網絡抽檢涉及的207批次樣品經檢驗均符合規定。各省(區、市)樣品抽取情況以及所抽取樣品的標示生產企業所在地區抽樣分布情況,分別見圖2與圖3。
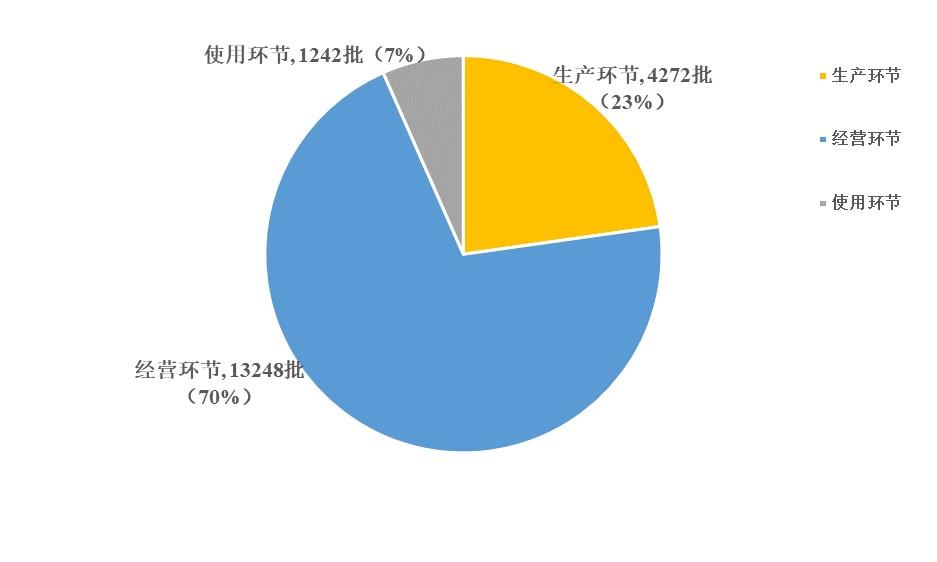 圖1. 2023年國家藥品抽檢各抽樣環節抽樣情況
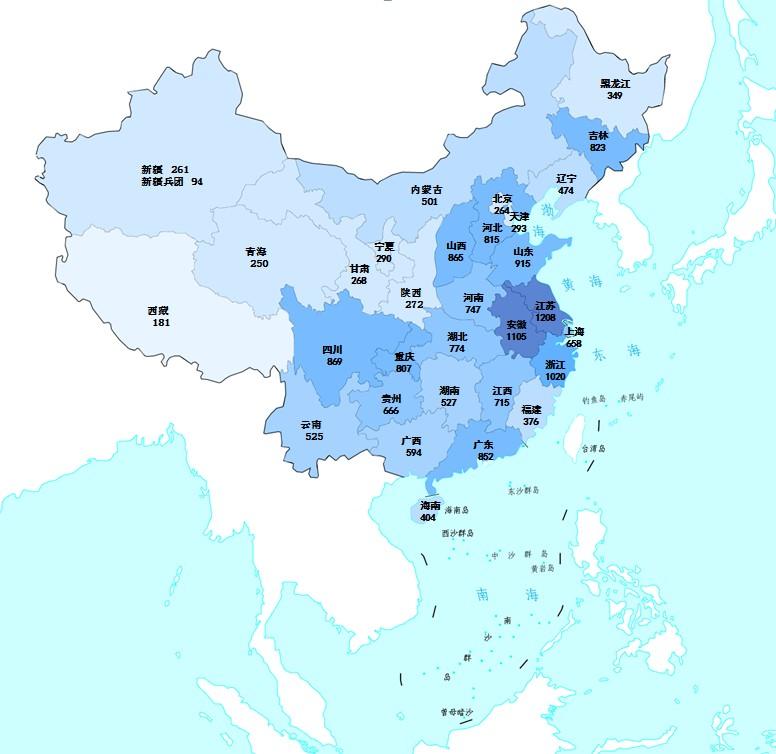 圖2.2023年國家藥品抽檢樣品來源分布圖
注:圖中數字為各省抽樣批次數,顏色由淺到深分別表示抽樣批次數由低到高。
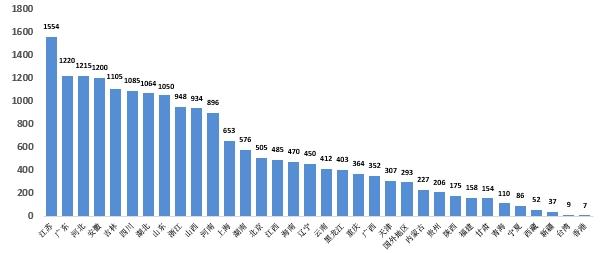 圖3. 2023年國家藥品抽檢樣品產地分布圖
(二)藥品制劑抽檢數據分析
2023年國家藥品抽檢共抽檢制劑產品16604批次。經檢驗,16531批次產品符合規定,73批次產品不符合規定。抽檢的123個品種中,全部樣品符合規定的制劑品種有106個,共13765批次。其中,化學藥品有65個品種9238批次,中成藥有35個品種4400批次,生物制品有6個品種127批次。
1.化學藥品
2023年國家藥品抽檢共抽檢化學藥品74個品種(化學藥52個、抗生素12個、生化藥10個)10893批次,涉及生產環節2436批次、經營環節7606批次、使用環節720批次、互聯網環節131批次。經檢驗,符合規定10849批次,不符合規定44批次,在生產、經營、使用、互聯網檢出不符合規定樣品2、40、2和0批次,分別占對應環節全部樣品的0.1%、0.5%、0.3%和0.0%。(見圖4)。
不符合規定項目包括檢查和含量測定,不符合規定產品數量依次為9批次、35批次,分別占全部不符合規定項目的20.5%和79.5%(見圖5)。
2023年國家藥品抽檢化學藥品共涉及13個劑型,共有6個劑型存在不符合規定樣品。其中注射劑(2批次)、片劑(3批次)、顆粒劑(33批次)、軟膏劑(4批次)、眼用制劑(1批次)、口服溶液劑(1批次)分別占對應劑型全部產品的0.1%、0.1%、9.1%、1.1%、0.4%和0.2%(見圖6)。
抽檢結果提示,生產企業應嚴格原料入廠檢驗,優化生產工藝管理與關鍵質量參數控制,重點關注滅菌工藝、原輔料投料量、分裝的穩定性,對檢查項目及檢驗指標反映的問題予以深入研究;經營企業應強化藥品儲存、運輸過程管理,提升溫濕度監控體系,重點關注需要陰涼、冷藏儲存等特殊條件保存的藥品;建議監管部門嚴格審查企業批生產記錄,核查原輔料投料量,推動質量標準提升。
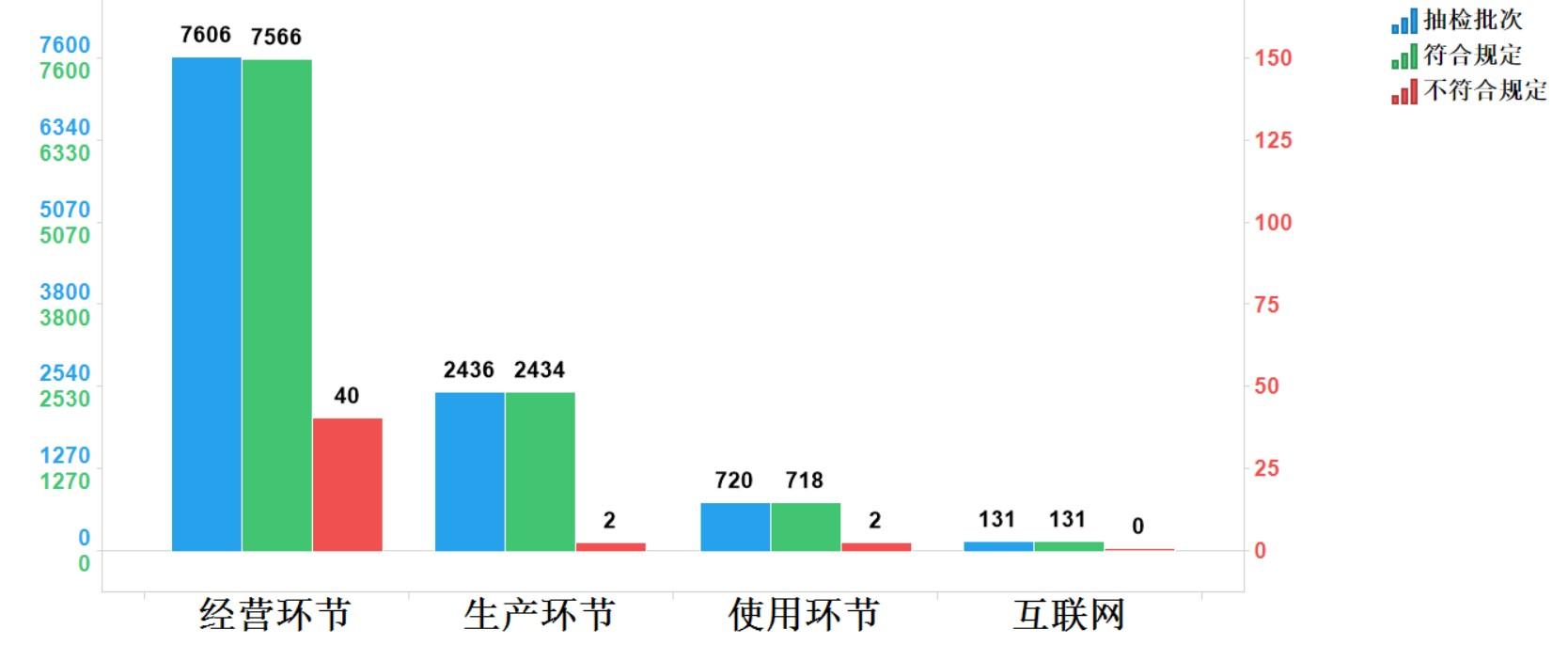 圖4.化學藥品各抽樣環節檢驗信息示意圖
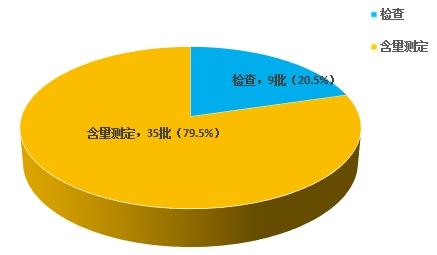 圖5.化學藥品不符合規定項目分布圖
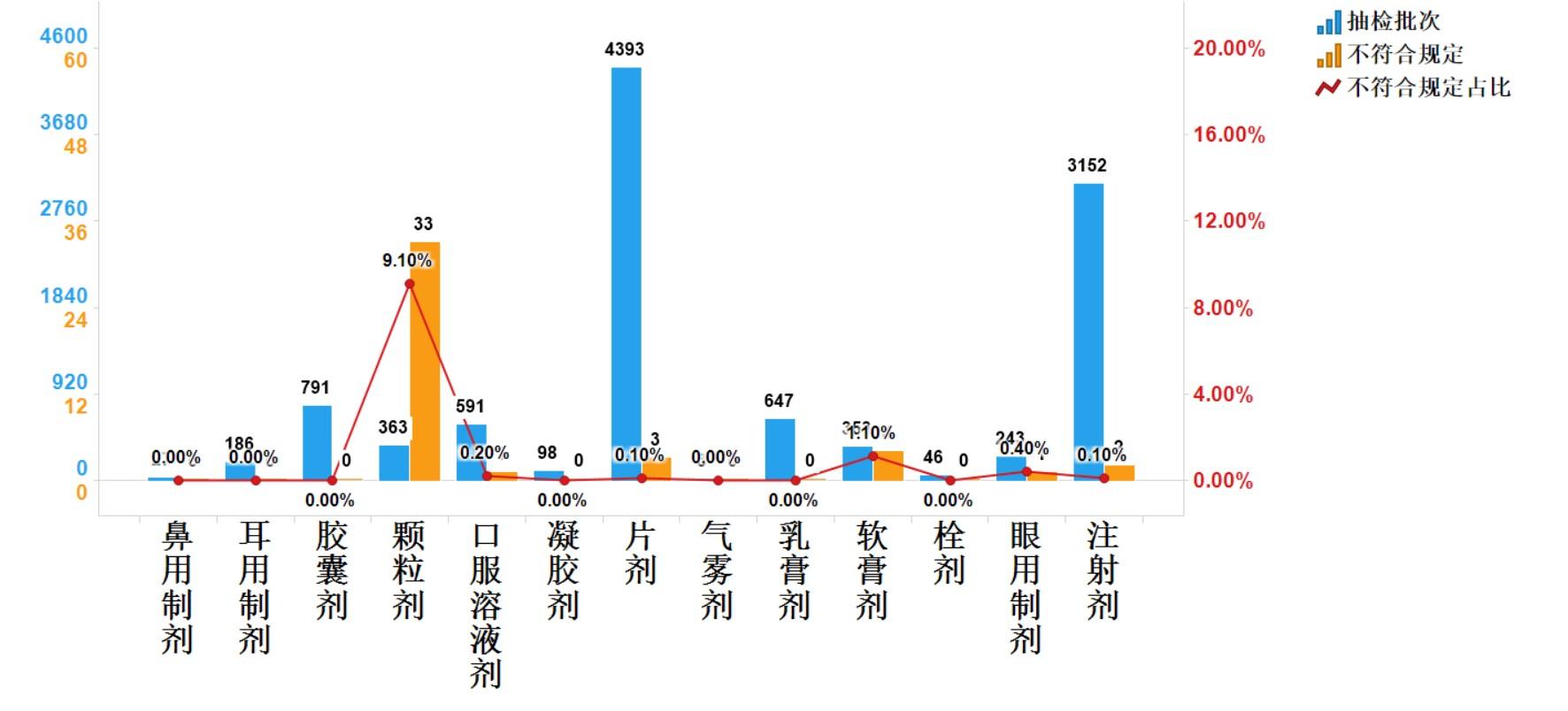 圖6.化學藥品各劑型檢驗信息示意圖
2.中成藥
2023年國家藥品抽檢共抽檢中成藥43個品種5584批次,涉及11個劑型,在生產、經營、使用、互聯網環節各抽取樣品841批次、4619批次、48批次、76批次。經檢驗,符合規定5555批次,不符合規定29批次,均在經營環節檢出,占對應環節全部樣品的0.6%(見圖7)。
不符合規定項目主要涉及鑒別和檢查,不符合規定產品數量依次為10和19批次,分別占全部不符合規定項目的34.5%和65.5%(見圖8)。
2023年國家藥品抽檢中成藥涉及11個劑型,共有4個劑型存在不符合規定產品,其中片劑(16批次)、丸劑(7批次)、貼膏劑(4批次)和糖漿劑(2批次),分別占對應劑型全部樣品的1.2%、0.5%、2.4%和0.7%(見圖9)。
抽檢結果提示,生產企業應強化主體責任意識,嚴把原藥材質量關,從源頭把控藥材質量,嚴格投料藥材入廠檢驗,加強內部質量控制和生產管理水平,優化生產關鍵質量參數控制;經營企業應完善藥品運輸、儲存過程管理;建議監管部門加強對生產企業的監督檢查,督促其嚴格按照處方工藝投料,嚴格執行GMP規范,從而保證中成藥的質量及療效。
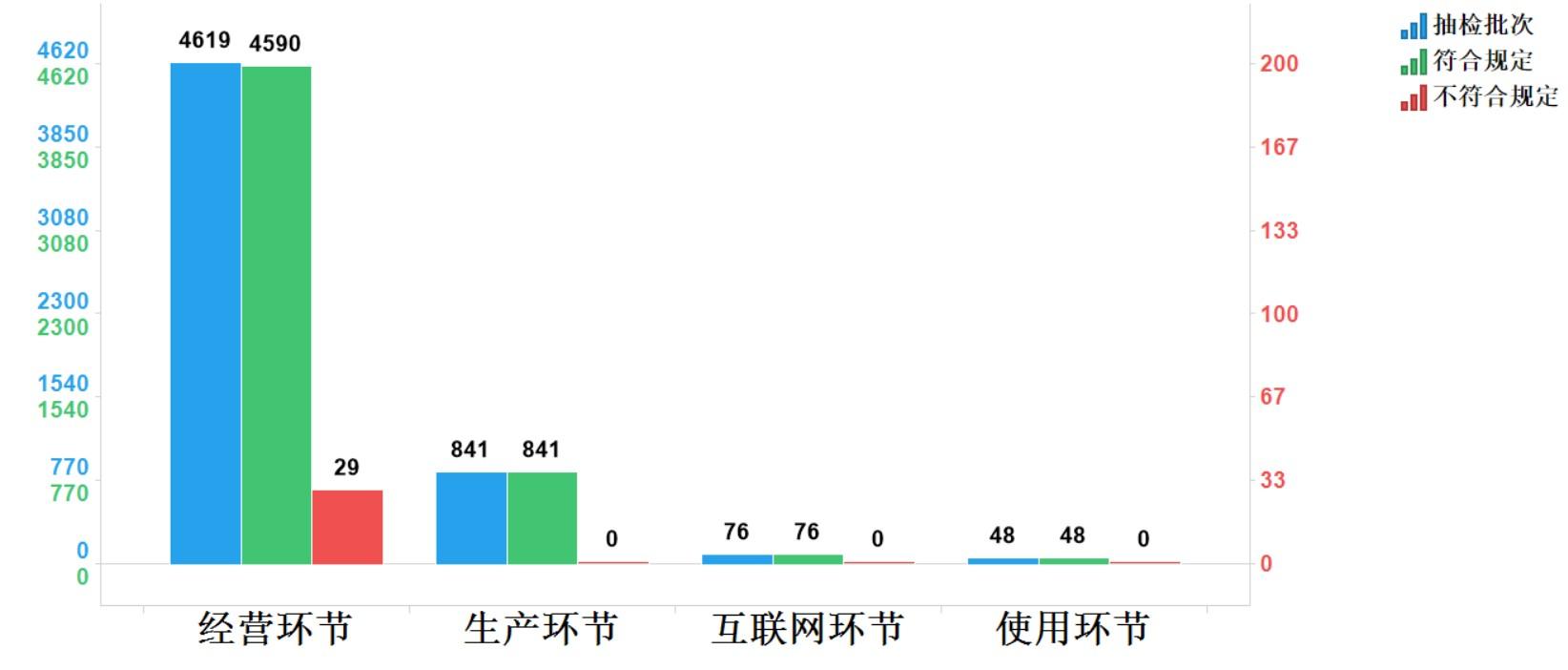 圖7.中成藥各抽樣環節檢驗信息示意圖
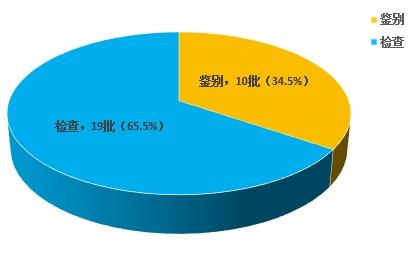 圖8.中成藥不符合規定項目分布圖
注:某些不符合規定產品涉及多個不符合規定項目。
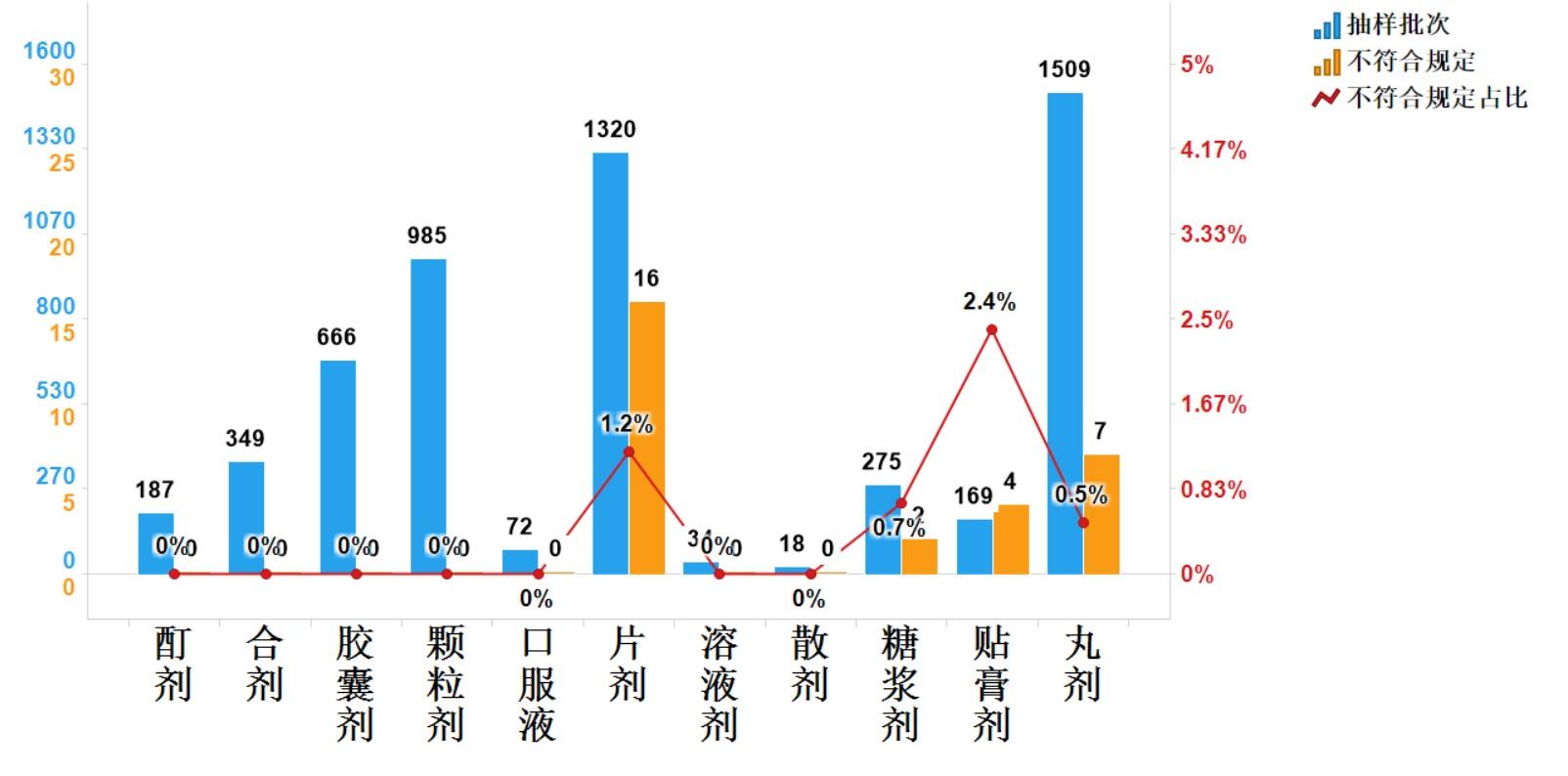 圖9.中成藥各劑型檢驗信息示意圖
3.生物制品
2023年國家藥品抽檢共抽檢生物制品6個品種127批次,其中生產、經營、使用環節分別抽取50批次、70批次、7批次。其中涉及治療類品種 5個,預防類品種1個。劑型為注射劑和體外診斷試劑(見圖10)。經檢驗,所檢項目均符合規定,合格率為100%。
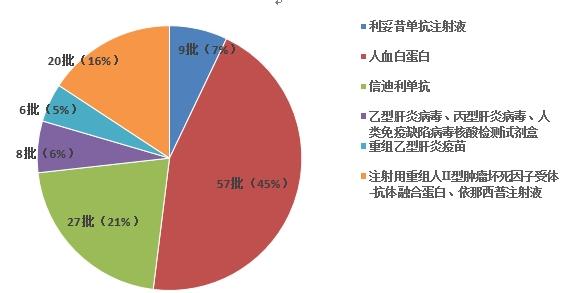 圖10.生物制品抽檢品種信息示意圖
4. 國家基本藥物
2023年國家藥品抽檢共抽檢國家基本藥物(不含中藥飲片)39個品種6140批次,在生產、經營、使用、互聯網環節各抽取樣品1570批次、4120批次、332批次、118批次。經檢驗,不符合規定13批次,分別在生產、經營環節檢出不符合規定產品1批次和12批次,涉及2個劑型。抽檢結果顯示,國家基本藥物整體質量狀況較好(見圖11)
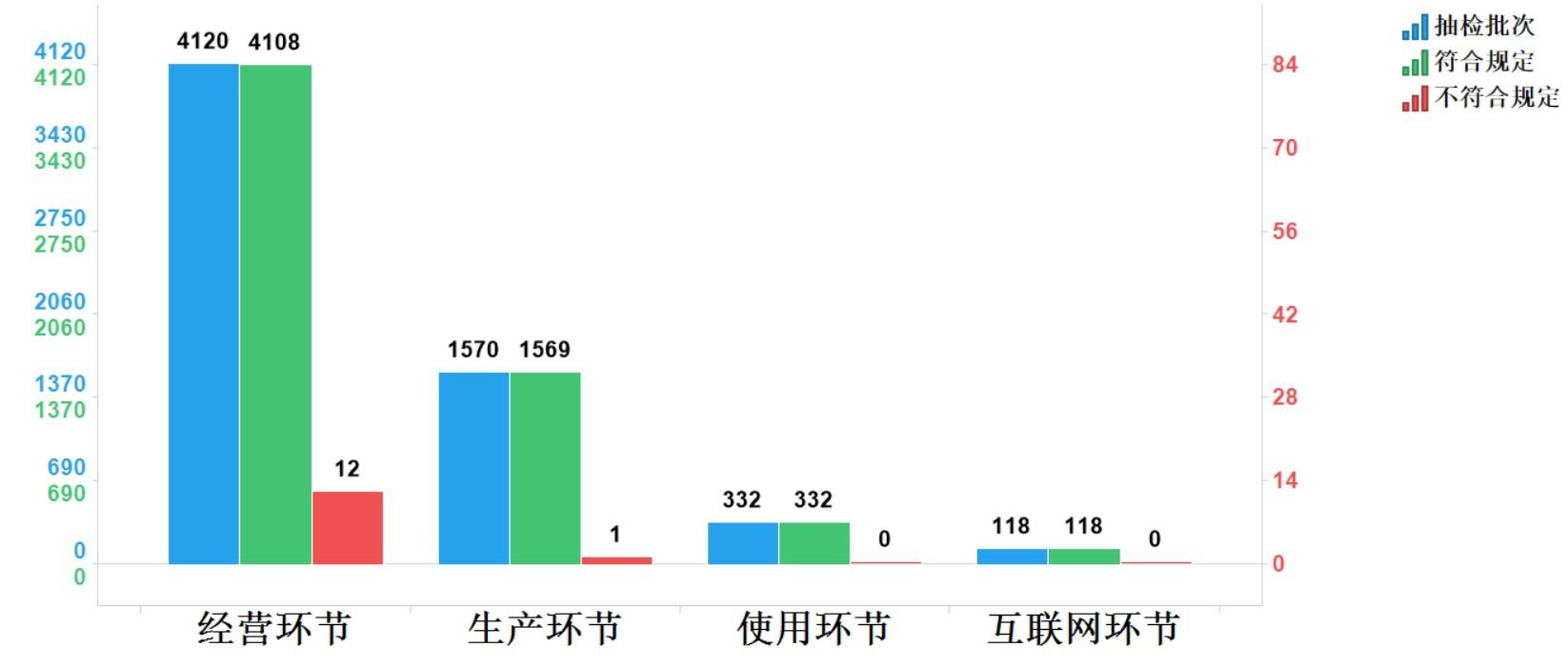 圖11.國家基本藥物各抽樣環節檢驗信息示意圖
5. 國家藥品集中采購中選品種
2023年國家藥品抽檢共抽檢國家藥品集中采購中選品種20個品種3435批次,在生產、經營、使用、互聯網環節各抽取樣品887批次、2201批次、290批次、57批次。經檢驗,集中采購涉及樣品均符合規定。抽檢結果顯示,國家藥品集中采購中選品種整體質量狀況較好(見圖12)。
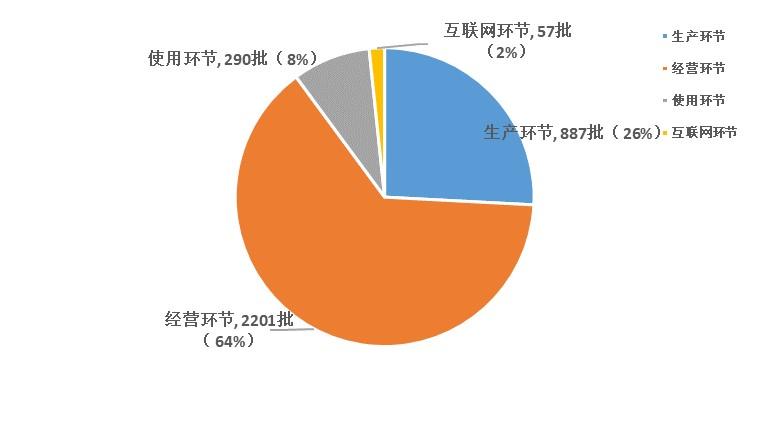 圖12. 2023年國家藥品集中采購中選品種各環節抽樣情況
6.進口藥品(不含進口中藥材)
2023年,國家藥品抽檢共抽檢進口藥品309批次,涉及9個劑型(見圖13),其中生產環節11批次、經營環節257批次、使用環節41批次(見圖14)。經檢驗,所檢項目均符合規定,合格率為100%。
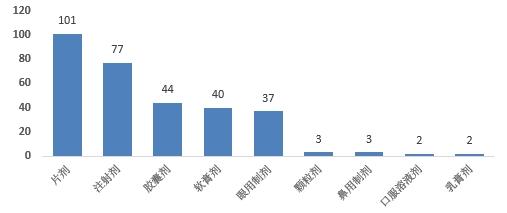 圖13.進口藥品各劑型檢驗信息示意圖
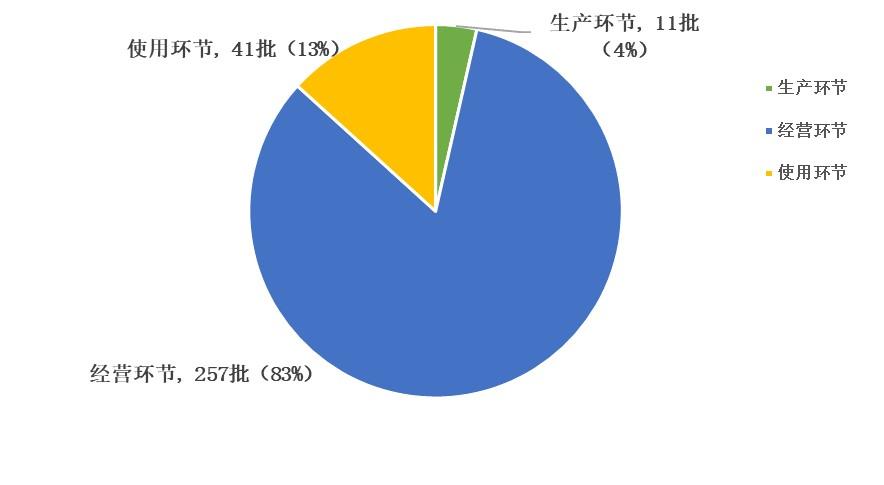 圖14. 進口藥品各抽樣環節檢驗信息示意圖
(三)中藥飲片專項抽檢及中藥材質量監測情況
2023年,國家藥監局繼續組織開展中藥飲片專項抽檢。全年共抽檢9個中藥飲片品種2158批次(其中配方顆粒234批,飲片1924批),重點針對可能存在的染色、增重、摻偽或摻假、不規范種植等質量問題,開展檢驗和探索性研究。經檢驗,符合規定2095批次,不符合規定63批次(見圖15)。
不符合規定項目主要涉及性狀(4批次)、薄層色譜鑒別(3批次)、微生物限度(1批次)、含量測定(17批次)、指紋圖譜(1批次)、總灰分(9批次)、水分(37批次)、酸不溶性灰分(1批次)等方面,分別占全部不符合規定項目的5.5%、4.0%、1.4%、23.3%、1.4%、12.3%、50.7%、1.4%。(見圖16)
同時,為貫徹落實《中華人民共和國中醫藥法》有關要求,國家藥監局繼續組織開展中藥材質量監測,組織對部分藥品生產企業、藥材市場集散地或種植集中區的中藥材質量進行監測。2023年中藥材質量監測,共監測9個品種251批次樣品,其中,藥品生產企業224批次,市場集散地或種植集中區27批次。所有樣品按照不同品種特點,針對相應項目進行了研究性檢驗,主要針對摻雜摻偽、加工炮制規范、農藥殘留等問題開展。
2023年中藥飲片專項抽檢及中藥材質量監測發現的主要問題有:一是混偽品摻偽問題,如硼砂蠶摻偽僵蠶(炒僵蠶)、理棗仁摻偽酸棗仁;二是非法染色問題,如炒酸棗仁檢出胭脂紅;三是外源性有害物質殘留超限問題,部分飲片存在真菌毒素殘留、農藥殘留、重金屬及有害元素超標等隱患,如部分批次麩炒薏苡仁黃曲霉毒素及玉米赤霉烯酮超標、部分批次炒酸棗仁及炒酸棗仁配方顆粒黃曲霉毒素B1超標、部分批次地骨皮檢出禁用農藥氟蟲氰、部分批次地骨皮重金屬超出通則限量規定、部分批次丹參及丹參配方顆粒、甘草及甘草配方顆粒檢出植物生長調節劑等;四是采收加工與加工炮制不規范問題,如酸棗仁、女貞子等存在搶青采收導致質量下降,地骨皮產地加工泥沙清洗不完全,防己存在產地趁鮮加工現象。
抽檢及監測結果顯示,我國中藥飲片總體質量狀況良好。但中藥飲片全產業鏈參與者應進一步提高質量意識和責任意識,中藥飲片生產企業應提升全程質量控制意識,首先加強藥材溯源、供應商資質審核管理,重點關注原料摻偽、有害物質殘留等問題,做好原料管控,其次生產前做好工藝驗證,生產中嚴格遵照炮制規范要求執行,第三把好檢測及貯存環節管理關口,保證飲片質量的真實穩定;藥品行政管理部門應督促藥品上市許可持有人嚴格控制工藝規程與購進藥材質量,繼續強化中藥材及飲片的市場監測。
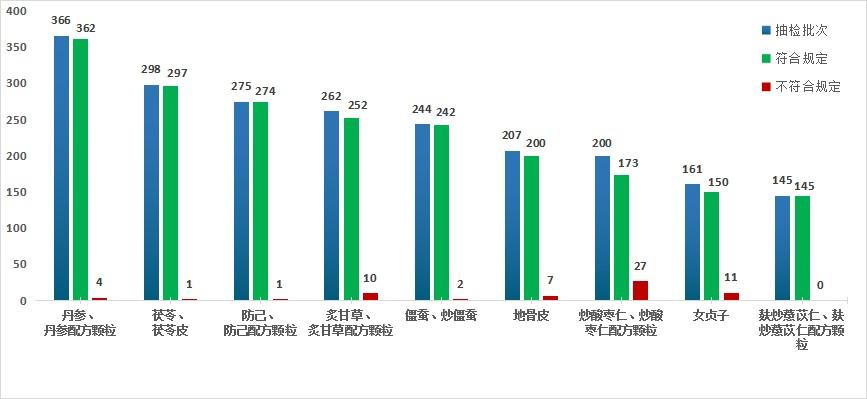 圖15.2023年中藥飲片專項抽檢結果
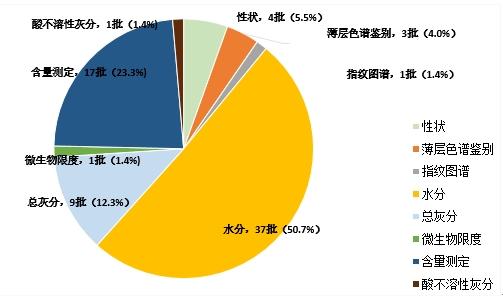 圖16. 2023年中藥飲片專項抽檢不符合規定項目分布圖
注:某些不符合規定產品涉及多個不符合規定項目。
(四)探索性研究
2023年,在多年技術儲備的基礎上,各藥品檢驗機構法定藥品標準方法與探索性研究方法檢驗并重,充分利用探索性研究的利器,全面考察藥品質量的穩定性、現行標準的可行性,同時探尋可能存在的潛在風險,為提升藥品質量標準、提高監督管理水平提供科學可靠的技術支撐。發現的主要問題有:
一是中藥飲片混用摻偽問題,使用偽品、摻偽的中藥材及飲片生產中藥制劑的問題仍然存在;二是個別企業違法違規生產問題仍然存在,如擅自改變生產工藝,低限或使用摻偽、替代品投料,違反關鍵工藝制法,擅自改變或添加輔料、防腐劑和抑菌劑等;三是不同廠家因原料藥質量差異、生產工藝不穩定等原因,導致產品均一性較差;四是外源性有害物質超限,部分品種重金屬、農藥、真菌毒素殘留量超限;五是包裝材料相容性問題影響產品質量穩定性。
三、抽檢結果應用
藥品抽檢作為藥品監管的重要手段,在發現藥品質量風險、打擊違法違規行為中發揮著不可替代的重要作用,是實現科學監管、嚴格監管的重要技術支撐。國家藥品抽檢的目的不僅僅是把控風險、規范生產和保障藥品質量安全,其成果的積極運用更是持續提升藥品質量,推動產業提質升級的重要途徑。
(一)推進政策支撐,完善抽檢制度體系建設
國家藥監局持續加強抽檢制度建設和頂層設計,推動抽檢工作更加科學。2023年,印發《關于進一步做好地方藥品抽檢有關工作的通知》,對地方抽檢工作提出更為明確且具體的要求,加強國家與地方抽檢的銜接互補;持續推進藥品抽檢制度體系優化創新,健全完善抽檢工作機制和工作程序,推進修訂《藥品抽檢探索性研究原則及程序》,規范指導探索性研究;修訂《藥品抽樣原則及程序》,細化完善中藥材和中藥飲片的取樣、制樣方法,探索網抽購樣方式方法。著力提升服務藥品監管實際需求的能力。
(二)聚焦社會熱點,主動開展專項風險監測
近年來,藥品安全突發事件是公眾和媒體關注的焦點,隨著檢測分析技術的日新月異,一些已上市成熟藥品中未曾暴露的質量安全性問題被逐漸揭示。配合國家重大醫藥政策執行,聚焦社會熱點、潛在風險點、監管的難點堵點等,國家藥品抽檢每年設置不同專項,對國家集采中選、兒童用藥、生物制品等重點品種進行專項研究,為科學監管提供技術支撐。針對可能的風險點,2023年還專門設置馬兜鈴酸研究、溶劑殘留研究、網絡抽檢等專項,潛在風險得到有效控制,例如針對境外報道糖漿劑出現乙二醇/二甘醇污染情況,開展溶劑殘留研究,其中部分專項研究成果還被國際認可,如溶劑殘留研究的工作成果已被收入《國際藥典》。
(三)深入排查風險,查控假劣藥品
2023年,國家藥監局依照“風險控制-依法處置-排查原因并整改-信息公開”的監管模式,確保風險關閉、警示用藥安全。組織各省級藥品監管部門對國家藥品抽檢發現的136批次不符合規定產品,在第一時間采取了查封扣押、暫停銷售使用、要求企業主動召回等風險控制措施;對涉及的相關企業和單位均依法組織查處;同時要求藥品生產企業認真排查,督促其查找問題原因并切實整改,確保質量安全隱患得到及時有效清除。通過藥品抽檢嚴厲打擊了制售假劣藥品的行為,發揮了震懾不法企業、凈化市場環境的作用。此外,國家藥監局在2023年共發布藥品補充檢驗方法4個,為打擊隱蔽性極強的摻雜摻假等違法行為提供了監管利器,也為企業提供了保障藥品質量安全的科學依據。
(四)深化風險提示,寓服務于監管
對探索性研究中發現的有關生產工藝、處方、原輔料、包裝材料、說明書等方面可能存在的一般性問題,藥品監督管理部門通過“藥品質量提示函”等形式反饋相關企業,提升企業的質量意識,加強企業主體責任的落實。例如,鹽酸倍他司汀片的探索性研究發現,部分企業濕法制粒后干燥時間過長可能影響蔗糖含量,提示應當優化生產工藝參數;止咳寧嗽膠囊的探索性研究發現,部分批次產品苦杏仁苷含量偏低,提示企業應當加強原藥材質量管控。
相關企業主動采取修訂內控標準、完善工藝、加強供應商審計、修訂說明書等整改措施,提升產品質量水平;各省局也通過多部門聯席會、約談企業、風險溝通、跟蹤檢查等方式,利用提示信息強化對企業的監督指導。通過寓服務于監管的風險提示,加深了監管部門、藥檢機構和企業之間的信任與理解,促進了持有人主體責任的落實,是主動排查、預防為主監管方式的有益探索。
(五)及時信息公開,助力智慧監管
國家藥監局繼續以通告的形式,依法及時向公眾警示不符合規定藥品抽檢信息,筑牢公眾用藥安全防線,2023年共發布藥品抽檢通告7期,對全部不符合規定藥品及涉及企業依法公開,震懾不法企業、警示安全用藥。中檢院在官方網站持續公開國家藥品抽檢的探索性研究結果,2023年共發布39個品種的新建檢驗方法。通過信息的共享利用,進一步促進藥品上市許可持有人及相關生產經營企業的質量安全意識和主體責任自律意識,增強藥品質量風險控制能力,促進產品研發創新升級。
四、結語
2023年國家藥品抽檢工作順利完成。檢驗及研究結果顯示,我國藥品質量仍處于較高水平,整體安全形勢穩中向好。
2024年是中華人民共和國成立75周年,是實施“十四五”規劃的關鍵一年,國家藥監局將認真落實習近 平總書記關于藥品監管工作的重要指示批示精神,將“四個最嚴”要求貫徹落實到每一個具體的監管實踐中,進一步強化風險意識,持續筑牢藥品安全底線,提升藥品監管效能,加快構建更加科學高效權威的藥品上市后監管體系,推動我國從制藥大國向制藥強國跨越,更好地保障人民群眾用藥安全。
小貼士
1.藥品抽檢歷史沿革
1956年,我國首次提出藥品計劃抽檢的概念;1964年,原衛生部第一次制定國家級年度藥品抽檢計劃并組織實施;1984年頒布《中華人民共和國藥品管理法》,第一次從法律上明確了藥品抽檢工作的地位;1986年,實行藥品質量公報制度;1990年,實行藥品抽檢收費制度,即抽檢藥品須由被抽檢單位付檢驗費;2001年,《中華人民共和國藥品管理法》修訂,取消了藥品抽檢收費制度,所需費用由財政列支;2019年,《中華人民共和國藥品管理法》再次修訂,明確“藥品監督管理部門根據監督管理的需要,可以對藥品質量進行抽查檢驗”、“抽樣應當購買樣品”。
2.藥品標準檢驗
藥品標準檢驗是指具有檢驗資質的藥品檢驗機構,依據國家藥品監督管理部門批準的法定檢驗標準中的檢驗方法,進行全項目或部分項目的檢驗,并依法出具檢驗報告書的過程。
3.探索性研究
探索性研究是指在藥品抽檢中,除按照藥品標準進行檢驗并判定藥品是否符合標準規定之外,根據監管工作需要,進一步針對抽檢樣品可能存在的質量風險,采用藥品標準以外的檢驗項目和檢測方法對藥品質量進行進一步分析研究的過程,可為防控潛在風險隱患、提升藥品質量水平、加強藥品監管提供技術支撐。
4.國家基本藥物
國家基本藥物是適應基本醫療衛生需求,劑型適宜,價格合理,能夠保障供應,公眾可公平獲得的藥品。國家基本藥物目錄是各級醫療衛生機構配備使用藥品的依據。《國家基本藥物目錄(2018年版)》中的藥品包括化學藥品和生物制品、中成藥、中藥飲片3部分,其中,化學藥品和生物制品主要依據臨床藥理學分類,共 417個品種;中成藥主要依據功能分類,共268個品種;中藥飲片不列具體品種,頒布國家標準的中藥飲片為國家基本藥物,國家另有規定的除外。
5.藥品補充檢驗方法
藥品補充檢驗方法和檢驗項目(藥品補充檢驗方法)適用于有摻雜、摻假嫌疑,且國家藥品標準規定的檢驗方法和檢驗項目不能檢驗的藥品檢驗。經國務院藥品監督管理部門批準后,使用補充檢驗方法和檢驗項目所得出的檢驗結果,可以作為藥品監督管理部門認定藥品質量的依據。
6.檢驗項目
性狀項下記載藥品的外觀、臭、味、溶解度以及物理常數等,在一定程度上反映藥品的質量特性。
鑒別項下規定的試驗方法,系根據反映該藥品的某些物理、化學或生物學等特性所進行的藥物鑒別試驗,不完全代表對該藥品化學結構的確認。
檢查項下包括反映藥品的安全性與有效性的試驗方法和限度、均一性與純度等制備工藝要求等內容;對于規定中的各種雜質檢查項目,系指該藥品在按既定工藝進行生產和正常貯藏過程中可能含有或產生并需控制的雜質(如殘留溶劑、有關物質等);改變生產工藝時需另考慮增修訂有關項目。
含量測定項下規定的試驗方法,用于測定原料及制劑中有效成分的含量,一般可采用化學、儀器或生物測定方法。
附表
2023年國家藥品抽檢品種目錄
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|